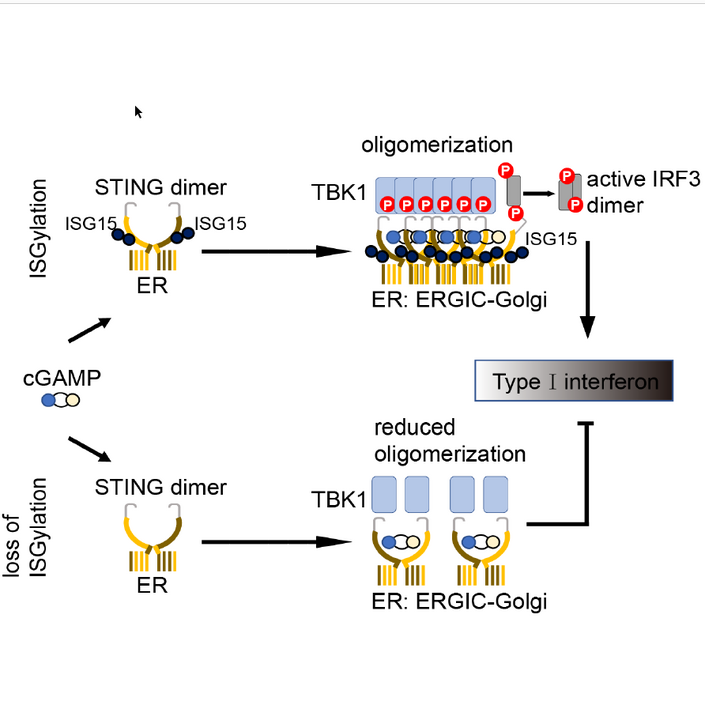
Unter regulären Bedingungen erhält das STING Protein nach der DNA-Erkennung durch cGAS ein Aktivierungssignal. In der Folge formen STING-Moleküle Multimere (Oligomere) und bilden dann nach einer Relokalisation einen Signalkomplex, der zur Bildung von Interferon führt (Abb. 1).
Die Forscher aus der HIV-Arbeitsgruppe von Prof. Dr. Carsten Münk, Klinik für Gastroenterologie, Hepatologie und Infektiologie (Direktor Prof. Dr. Tom Lüdde), haben nun in einer Studie einen neuartigen Mechanismus der Regulation der Aktivierung dieses STING-Proteins nachweisen können. Die Studie wurde durch die Zusammenarbeit mit Dr. Renate König, Paul-Ehrlich-Institut und Prof. Dr. Holger Gohlke, Institut für Pharmazeutische und Medizinische Chemie der Heinrich-Heine-Universität Düsseldorf möglich. Der neu nachgewiesene Mechanismus „ISGylierung“ bezeichnet die Bindung eines bestimmten Proteins (hier STING) mit einem zweiten, kleinen Protein, ISG15. Durch die Entdeckung, dass STING-Aktivierung die ISGylierung von STING benötigt, ist jetzt ein neuer Ansatz gefunden worden, die STING-Aktivität zu regulieren. Dies kann neue Behandlungsmöglichkeiten in chronischen Virusinfektionen (wie HIV-1), akuten Virusinfektionen (wie SARS-CoV-2), autoinflammatorischen Erkrankungen und Krebserkrankungen ermöglichen.
Originalpublikation:
Chaohui Lin, Edmund Osei Kuffour, Nina V. Fuchs, Christoph G. W. Gertzen, Jesko Kaiser, Maximilian Hirschenberger, Xiao Tang, Haifeng C. Xu, Oliver Michel, Ronny Tao, Alexandra Haase, Ulrich Martin, Thomas Kurz, Ingo Drexler, Boris Görg, Philipp A. Lang, Tom Luedde, Konstantin M. J. Sparrer, Holger Gohlke, Renate König, Carsten Münk.
Regulation of STING activity in DNA sensing by ISG15 modification. Cell Reports, 2023 Oct 20;42(11):113277. doi: 10.1016/j.celrep.2023.113277. Online ahead of print. https://doi.org/10.1016/j.celrep.2023.113277
Im Detail:
Fremde, virale, wie auch zelluläre DNA im Zytoplasma wird dabei von der Zelle als Alarmsignal erkannt und löst die Bildung von Interferon aus. So kommt es in Krankheitsprozessen häufig zur ungewollten Freisetzung von mitochondrialer DNA ins Zytoplasma. In vielen Krebserkrankungen entstehen sogenannte Mikrokerne mit chromosomaler DNA, die dann auch ins Zytoplasma austritt. cGAS-STING wird auch in sogenanntnen autoinflammatorischen Erkrankungen ohne Virus-Beteiligung aktiviert und führt zu Entzündungsreaktionen und chronisch-degenerativen Veränderungen.
In den ersten Experimenten fiel den Forschern auf, dass HIV-1 Infektionen in Makrophagen ohne ISG15 100 – bis 1000-fach stärker verlaufen als in normalen, Wildtyp-Makrophagen. Es zeigte sich, dass HIV-1 verstärkt diese Makrophagen infizierte, weil diese Zellen die in der viralen reversen Transkription gebildete virale DNA nicht mehr erkannten und kein Interferon bildeten. „Das war das Aha-Experiment, das uns zur Analyse des cGAS-STING DNA Erkennungsweges führte“, sagt Prof. Münk. Die Aktivierung des STING-Proteins funktioniert nur effizient, wenn es an einer bestimmten Aminosäure (Lysin 289) ISG15 gebunden ist. Dr. König verifizierte diese Aminosäure in den physiologisch relevanten Zellen. Die Ergebnisse konnten dann in daraus abgeleiteten hämatopoetischen Vorläuferzellen validiert werden. Prof. Gohlke konnte mit molekularer Modellierung und Simulationen erklären, wie ISGylierung von STING ein wichtiger Regulator der STING-Oligomerisierung ist. Die Befunde zeigten, dass die ISG15-Modifikation (ISGylierung) notwendig ist, damit das STING-Protein nach cGAMP-Bindung in einen oligomeren Zustand übergehen und dann Interferon induzieren kann.
HIV-1 selbst kann zu einem gewissen Grad die Erkennung seiner DNA hemmen, in dem es eine zelluläre Protease induziert, USP18. USP18 ist ein Protein, dass ISG15 wieder von so modifizierten Proteinen entfernt. Interessanterweise exprimiert SARS-CoV-2-Virus ein Protein, dass auch De-ISGylierungs-Aktivität wie USP18 hat. Deshalb kann man davon ausgehen, dass SARS-CoV-2-Infektionen zu einer Unterdrückung der Erkennung von zytoplasmatischer DNA führt, die auch in Folge von pathogen RNA-Virus-Infektion durch Mitochondrien freigesetzt wird. In Menschen mit bestimmten Mutationen im STING-Gen können STING-Proteine gebildet werden, die immer aktiviert sind und die Zellen zu ständiger Interferon-Bildung anregen. Menschen mit dieser, SAVI (STING-assoziierte Vaskulopathie mit Beginn in der Kindheit) genannten Erkrankung haben schwerste Krankheitsbilder und eine verkürzte Lebenserwartung. Die Studie, die jetzt in der renommierten Fachzeitschrift „Cell Reports“ publiziert wurde, konnte zeigen, dass STING mit SAVI-Mutation nur dann hyperaktiv ist, wenn das STING ISGyliert ist.