"Unsere Arbeit unterstreicht die bemerkenswerte Fähigkeit von Hirnorganoiden, primitive sensorische Strukturen zu erzeugen, die lichtempfindlich sind und Zelltypen beherbergen, die denen im Körper ähneln", sagt der Hauptautor der Studie, Prof. Jay Gopalakrishnan, Medizinische Fakultät der Heinrich-Heine-Universität Düsseldorf.
Viele Aspekte der menschlichen Gehirnentwicklung und -krankheiten können mit 3D-Gehirnorganoiden untersucht werden. Sie warden aus pluripotenten Stammzellen gewonnen, aus denen sich alle Zelltypen des Körpers entwickeln können. Forscher haben zuvor menschliche embryonale Stammzellen verwendet, um die Sehnervenkappe zu erzeugen, aus der die Netzhaut entsteht - die lichtempfindliche Gewebeschicht am hinteren Teil des Auges. In einer anderen Studie wurde gezeigt, dass aus iPSCs, die aus adulten Zellen stammen, die genetisch in einen embryonalähnlichen pluripotenten Zustand zurückprogrammiert wurden, Sehnapf-ähnliche Strukturen erzeugt werden können. In der Vergangenheit konzentrierte sich die Herstellung von Sehnervenköpfen aus pluripotenten Stammzellen auf die Erzeugung der reinen Netzhaut. Bislang wurden Sehnervenköpfe und andere 3D-Netzhautstrukturen nicht funktionell in Hirnorganoide integriert.
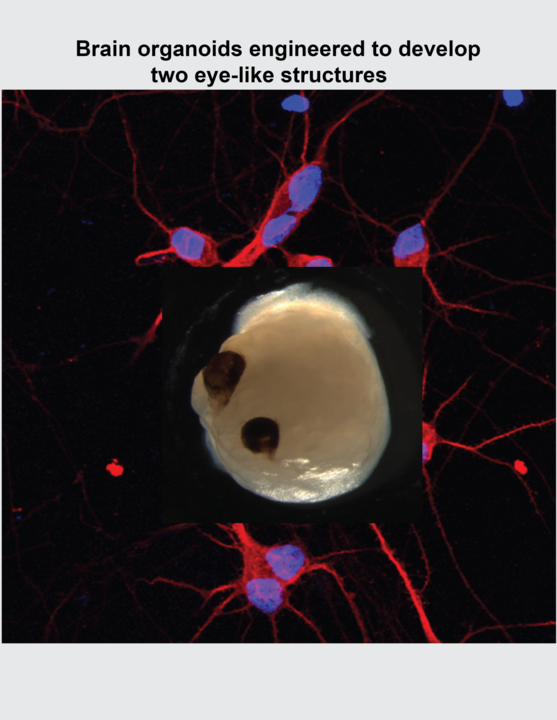
Um dieses Kunststück zu vollbringen, modifizierten Gopalakrishnan und sein Team ein Protokoll, das sie zuvor für die Umwandlung von iPSCs in neuronales Gewebe entwickelt hatten. Die menschlichen Hirnorganoide bildeten optische Becher, die bereits nach 30 Tagen erschienen und innerhalb von 50 Tagen zu sichtbaren Strukturen heranreiften. Dieser Zeitrahmen entspricht dem der Netzhautentwicklung im menschlichen Embryo und könnte bestimmte Arten von entwicklungsneurobiologischen Experimenten effizienter machen.
In 16 unabhängigen Chargen von vier iPSC-Spendern erzeugten die Forscher 314 Hirnorganoide, von denen 72 Prozent Sehnervenköpfe bildeten, was zeigt, dass die Methode reproduzierbar ist. Diese Strukturen enthielten verschiedene Zelltypen der Netzhaut, die elektrisch aktive neuronale Netzwerke bildeten, die auf Licht reagierten. Die Sehnapf-Gehirnorganoide enthielten auch Linsen- und Hornhautgewebe und wiesen eine Verbindung zwischen der Netzhaut und Gehirnregionen auf. "Im Gehirn von Säugetieren strecken sich die Nervenfasern der retinalen Ganglienzellen aus, um sich mit ihren Zielen im Gehirn zu verbinden, ein Aspekt, der bisher noch nie in einem In-vitro-System gezeigt wurde", sagt Gopalakrishnan.
In zukünftigen Studien wollen sie Strategien entwickeln, um die Sehnervenköpfe über lange Zeiträume lebensfähig zu halten und sie zur Untersuchung der Mechanismen zu verwenden, die Netzhauterkrankungen verursachen.
Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft (DFG) und von der Fritz Thyssen Stiftung unterstützt.
Originalpublikation:
Cell Stem Cell, Gabriel et al.: "Human brain organoids assemble functionally integrated bilateral optic vesicles" www.cell.com/cell-stem-cell/fulltext/S1934-5909(21)00295-2 DOI: 10.1016/j.stem.2021.07.010
Kontakt:
Susanne Dopheide
Stabsstelle Presse und Kommunikation /
Medizinische Fakultät, HHU Düsseldorf
Susanne.Dopheide@med.uni-duesseldorf.de
+49 (0)211 81-04173